重要性和挑战:规范药物临床试验工作

引言
临床试验作为药物研发过程中不可或缺的一环,对于药物获批上市和确保疗效与安全性具有重要作用. 近日,国家药监局(NMPA)发布了两份关于药物临床试验监管和安全信息评估的文件,旨在进一步规范临床试验相关工作. 这些新政策将提高临床试验质量,推动药物的高水平研发. 然而,这也将对药企的临床试验选择和合规成本带来新的考验.
药物临床试验监管的重要转折
2019年是我国药物临床试验监管的重要转折点. 新修订的《药品管理法》正式实施,明确了药物临床试机构的备案管理和药物临床试验默示许可制度. 这一政策推动了我国药物临床试验和机构数量的快速增长. 截至目前,全国已有超过1300家备案的药物临床试验机构,而2015年仅有400多家. 根据制药网的数据,临床试验项目管理系统2022年中国共有1668个新药临床试验申请,其中944个是1类新药。在这些申请中,化药创新药主要集中在肿瘤、血液疾病、心血管和消化领域,而生物创新药主要集中在肿瘤、血液疾病和免疫领域. 此外,生物药的申报类型主要集中在单抗、双抗、ADC、FC融合蛋白、干细胞疗法和CAR-T疗法。
挑战与乱象
随着临床试验的扩容,也出现了一些乱象。今年6月,中国临床肿瘤学会副理事长秦叔逵教授在2023抗肿瘤创新药物临床研究论坛上表示,国内大多数医院的临床研究水平不足。一些医院每年接受400到500项临床试验,但医生并没有亲自参与,而是全部交给临床协调员(CRC)和临床监查员(CRA),这对于研究质量构成了威胁. 针对这一问题,《监督检查办法》(征求意见稿)在检查对象上进行了侧重。根据该办法第九条的规定,将对试验机构、试验专业和研究人员进行监督检查.
规范药物临床试验的重要性
规范药物临床试验的目的是确保试验的科学性、透明度和可信度. 临床试验是确定药物疗效和安全性的金标准,因此试验质量至关重要. 通过监督检查和安全信息评估,可以提高试验的可靠性和准确性。同时,药物研发的进展也直接影响商业化前景. 因此,药企在选择临床试验机构和进行试验时需要更加谨慎,以降低潜在的风险和合规成本.
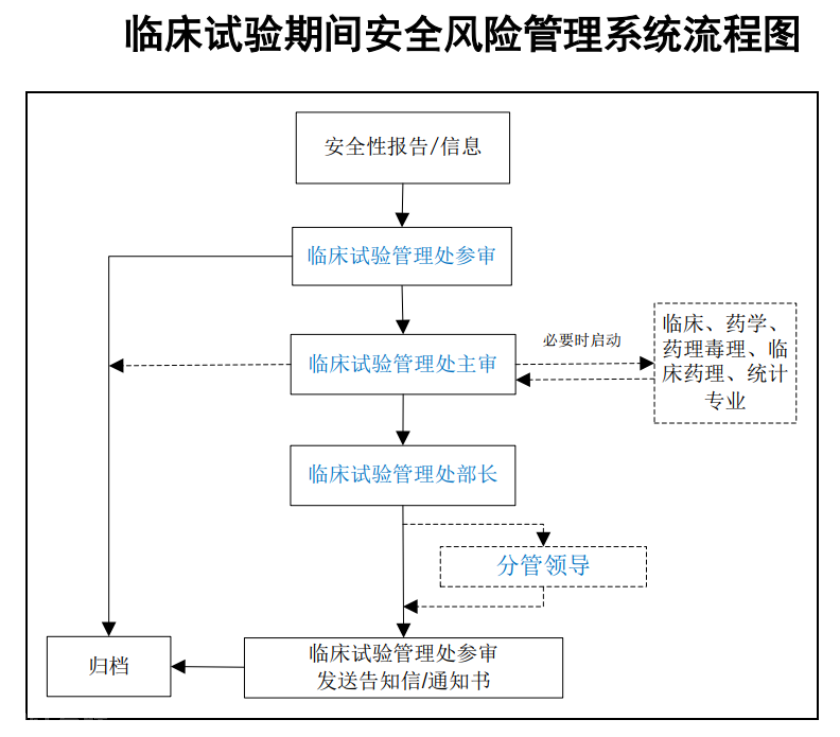
未来展望
随着我国药物研发的加速和临床试验的不断推进,规范药物临床试验的工作将变得更加重要. 新发布的文件将进一步提高临床试验的质量,推动药物的高水平研发. 在这个过程中,各方需要共同努力,确保临床试验的科学性和合规性,以促进药物研发的健康发展.
临床试验项目管理系统结论
药物临床试验的规范化是推动药物研发的关键一步。国家药监局发布的两份文件将对临床试验监管和安全信息评估进行进一步规范,以提高试验质量和推动药物的高水平研发. 在这个过程中,药企需要更加谨慎地选择临床试验机构,以确保合规性和降低风险。未来,我们期待着更加科学、规范和透明的药物临床试验工作,为药物研发的成功铺平道路.
图片来源:百度、人民网.


 咨询在线QQ客服
咨询在线QQ客服 


